Склад
діюча речовина: valganciclovir;
1 таблетка, вкрита плівковою оболонкою, містить валганцикловіру 450,0 мг у вигляді валганцикловіру гідрохлориду 496,3 мг;
допоміжні речовини: повідон К-30, кросповідон, целюлоза мікрокристалічна, порошок кислоти стеаринової;
оболонка таблетки: гіпромелоза 3 сР, гіпромелоза 6 сР, титану діоксид (Е 171), поліетиленгліколь 400, заліза оксид червоний (Е 172), полісорбат 80.
Лікарська форма
Таблетки, вкриті плівковою оболонкою.
Основні фізико-хімічні властивості: випуклі, овальні таблетки, вкриті плівковою оболонкою рожевого кольору, розміром 7,8 × 16,5 мм, з відбитком зверху VGC та відбитком знизу 450.
Фармакотерапевтична група
Противірусні засоби для системного застосування, противірусні засоби прямої дії, нуклеозиди та нуклеотиди, за винятком інгібіторів зворотної транскриптази. Валганцикловір.
Код ATХ J05A B14.
Фармакологічні властивості
Фармакодинаміка.
Валганцикловір є L-валіловим ефіром (проліками) ганцикловіру. Після прийому всередину валганцикловір швидко і активно метаболізується в ганцикловір кишковими і печінковими естеразами. Ганцикловір є синтетичним аналогом 2'-дезоксигуанозину та пригнічує реплікацію вірусів герпесу in vitro та in vivo. Чутливими вірусами людини є цитомегаловірус людини (ЦМВ), вірус простого герпесу 1 і 2 (ВПГ-1 і ВПГ-2), вірус герпесу людини 6, 7 і 8 (ВГЛ-6, ВГЛ-7, ВГЛ-8), вірус Епштейна ̶ Барр (ВЕБ), вірус вітряної віспи (ВВВ) і вірус гепатиту В (ВГВ).
У ЦМВ-інфікованих клітинах ганцикловір спочатку фосфорилюється вірусною протеїнкіназою pUL97 до ганцикловіру монофосфату. Далі фосфорилювання відбувається клітинними кіназами до отримання ганцикловіру трифосфату, який потім повільно метаболізується внутрішньоклітинно. Було показано, що метаболізм трифосфату відбувається у ВПГ- і ЦМВ-інфікованих клітинах з періодом напіврозпаду 18 годин та між 6 і 24 годинами відповідно після виведення ганцикловіру з позаклітинного простору. Оскільки фосфорилювання переважно залежить від вірусної кінази, фосфорилювання ганцикловіру в основному відбувається в інфікованих вірусом клітинах.
Вірусостатична активність ганцикловіру обумовлена інгібуванням синтезу вірусної ДНК шляхом конкурентного гальмування вбудовування дезоксигуанозину трифосфату в ДНК за допомогою вірусної ДНК-полімерази і включення ганцикловіру трифосфату у вірусну ДНК, що спричиняє термінацію або дуже обмежено – подальше подовження вірусної ДНК.
Противірусна активність
Антивірусна активність in vitro, виміряна як IC50 ганцикловіру проти ЦМВ, знаходиться в діапазоні 0,08 мкM (0,02 мкг/мл) – 14 мкM (3,5 мкг/мл).
Клінічний противірусний ефект препарату Вальцит® був продемонстрований в лікуванні хворих на СНІД із вперше діагностованим ЦМВ-ретинітом. Кількість пацієнтів з виділенням ЦМВ в сечі знизилося з 46 % (32/69) на початку дослідження до 7 % (4/55) у наступні чотири тижні лікування препаратом Вальцит®.
Фармакокінетика.
Фармакокінетичні властивості валганцикловіру вивчали у ВІЛ- та ЦМВ-серопозитивних пацієнтів, пацієнтів, хворих на СНІД і ЦМВ-ретиніт, і у пацієнтів після трансплантації паренхіматозних органів.
Пропорційність дозі показника AUC ганцикловіру після застосування 450–2625 мг валганцикловіру була продемонстрована тільки за умови прийому після вживання їжі.
Всмоктування
Валганцикловір є проліками ганцикловіру. Він добре всмоктується зі шлунково-кишкового тракту і швидко та активно метаболізується в стінці кишечнику і в печінці в ганцикловір. Системна експозиція валганцикловіру транзиторна і низька. Абсолютна біодоступність ганцикловіру з валганцикловіру приблизно 60 % у всіх групах пацієнтів, а підсумкова експозиція ганцикловіру аналогічна такій після його внутрішньовенного введення (див. нижче). Для порівняння, біодоступність ганцикловіру після прийому 1000 мг ганцикловіру перорально (у вигляді капсул) становить 6–8 %.
Валганцикловір у ВІЛ-позитивних, ЦМВ-позитивних пацієнтів
Показники системної експозиції у ВІЛ-позитивних, ЦМВ-позитивних пацієнтів після введення ганцикловіру і валганцикловіру два рази на добу протягом одного тижня наведено у таблиці 1.
Таблиця 1. Фармакокінетичні параметри у ВІЛ-позитивних, ЦМВ-позитивних пацієнтів після введення ганцикловіру і валганцикловіру два рази на добу протягом одного тижня
Параметр | Ганцикловір (5 мг/кг, внутрішньовенно) n = 18 | Валганцикловір (900 мг, перорально) n = 25 | |
Ганцикловір | Валганцикловір | ||
AUC(0-12 год) (мкг·год/мл/мл) | 28,6 ± 9,0 | 32,8 ± 10,1 | 0,37 ± 0,22 |
Сmax (мкг/мл) | 10,4 ± 4,9 | 6,7 ± 2,1 | 0,18 ± 0,06 |
Ефективність ганцикловіру у збільшенні часу до прогресування ЦМВ-ретиніту, як було показано, корелює з показником системної експозиції (AUC).
Валганцикловір у пацієнтів після трансплантації паренхіматозних органів
Сталий стан системної експозиції ганцикловіру у пацієнтів після трансплантації паренхіматозних органів після щоденного перорального введення ганцикловіру і валганцикловіру наведено у таблиці 2.
Таблиця 2. Фармакокінетичні параметри у пацієнтів після трансплантації паренхіматозних органів після щоденного перорального прийому ганцикловіру і валганцикловіру
Параметр | Ганцикловір (1000 мг 2 рази на добу) n = 82 | Валганцикловір (900 мг 1 раз на добу) n = 161 |
Ганцикловір | ||
AUC(0-24 год) (мкг·год/мл/мл) | 28,0 ± 10,9 | 46,3 ± 15,2 |
Сmax (мкг/мл) | 1,4 ± 0,5 | 5,3 ± 1,5 |
Системна експозиція ганцикловіру в серці, нирках і печінці реципієнтів була подібна після перорального прийому валганцикловіру відповідно до алгоритму дозування з урахуванням ниркової функції.
Ефект їжі
Коли валганцикловір застосовували з їжею в рекомендованій дозі 900 мг, були встановлені більш високі, ніж при прийомі натще, значення як середньої AUC ганцикловіру (близько 30 %), так і середньої Cmax ганцикловіру (близько 14 %). Крім того, індивідуальні відмінності у впливі ганцикловіру зменшуються при прийомі препарату Вальцит® з їжею. В клінічних дослідженнях Вальцит® застосовувався тільки з їжею. Тому рекомендується Вальцит® застосовувати під час їди (див. розділ «Спосіб застосування та дози»).
Розподіл
Через швидке перетворення валганцикловіру на ганцикловір зв’язування з білками валганцикловіру не було визначено. Сталий об’єм розподілу (Vd) ганцикловіру після внутрішньовенного введення становив 0,680 ± 0,161 л/кг (n = 114). Для ганцикловіру, що застосовується внутрішньовенно, об’єм розподілу корелює із масою тіла пацієнта і становить в рівноважному стані 0,54–0,87 л/кг. Ганцикловір проникає в спинномозкову рідину. При концентраціях ганцикловіру від 0,5 до 51 мкг/мл зв’язування з білками плазми становило 1–2 %.
Біотрансформація
Валганцикловір швидко і активно метаболізується в ганцикловір; жодних інших метаболітів не було виявлено. Ганцикловір значною мірою не метаболізується.
Виведення
Після перорального прийому валганцикловір швидко гідролізується до ганцикловіру. У пацієнтів з нормальною функцією нирок більше ніж 90 % внутрішньовенно введеного ганцикловіру виводилося з сечею у незміненому вигляді протягом 24 годин. У пацієнтів з нормальною функцією нирок після застосування валганцикловіру післяпікові концентрації ганцикловіру у плазмі знижувалися з періодом напіввиведення в діапазоні від 0,4 год до 2,0 год.
Фармакокінетика в особливих клінічних популяціях
Діти
У дослідженнях фармакокінетики та безпеки II фази за участю дітей після трансплантації паренхіматозних органів (у віці від 4 місяців до 16 років, n = 63) валганцикловір (порошок для орального розчину або таблетки) застосовували один раз на день протягом періоду до 100 днів. Параметри фармакокінетики були схожі за типом органів і віком та порівнянні з такими у дорослих. Популяційне фармакокінетичне моделювання показало біодоступність близько 60%. На кліренс позитивно впливають площа поверхні тіла і функція нирок.
У дослідженні фармакокінетики і безпеки I фази за участю дітей після трансплантації серця (віком від 3 тижнів до 125 днів, n = 14) валганцикловір (порошок для орального розчину) застосовували один раз на день протягом двох днів дослідження. За популяційною оцінкою фармакокінетики середня біодоступність становила 64%.
Порівняння результатів цих двох досліджень і фармакокінетичних результатів у дорослого населення показує, що діапазони AUC0-24 год були дуже схожі у всіх вікових групах, у тому числі у дорослих. Середні значення AUC0-24 год і Cmax були також схожі у вікових групах дітей віком <12 років, хоча спостерігалася тенденція зниження середніх значень AUC0-24год і Cmax у дітей усього вікового діапазону, що, як виявлено, корелює зі збільшенням віку. Ця тенденція була більш очевидною для середніх значень кліренсу і періоду напіввиведення (t½). Проте це було очікувано, оскільки кліренс залежить від змін маси, зросту і пов'язаної зі зростом ниркової функції, що було показано за допомогою популяційного фармакокінетичного моделювання.
У таблиці 3 узагальнено модель-оціночні діапазони AUC0-24 год ганцикловіру з цих двох досліджень, а також середнє і стандартне відхилення значення AUC0-24 год, Cmax, кліренсу і t½ у відповідних дитячих вікових групах у порівнянні з дорослими.
Таблиця 3. Фармакокінетичні параметри ганцикловіру у відповідних дитячих вікових групах у порівнянні з дорослими
Фармакокінетичний параметр | Дорослі* | Діти | ||||
≥ 18 років (n=160) | < 4 міс. (n=14) | 4 міс. – ≤ 2 р. (n=17) | > 2 – < 12 р. (n=21) | ≥ 12 р. – 16 р. (n=25) | ||
AUC0-24 год (мкг·год/мл) | 46,3 ± 15,2 | 68,1 ± 19,8 | 64,3 ± 29,2 | 59,2 ± 15,1 | 50,3 ± 15,0 | |
Діапазон AUC0-24 год | 15,4–116,1 | 34–124 | 34–152 | 36–108 | 22–93 | |
Cmax (мкг/мл) | 5,3 ± 1,5 | 10,5 ± 3,36 | 10,3 ± 3,3 | 9,4 ± 2,7 | 8,0 ± 2,4 | |
Кліренс (л/год) | 12,7 ± 4,5 | 1,25 ± 0,473 | 2,5 ± 2,4 | 4,5 ± 2,9 | 6,4 ± 2,9 | |
t½ (год) | 6,5 ± 1,4 | 1,97 ± 0,185 | 3,1 ±1,4 | 4,1 ± 1,3 | 5,5 ± 1,1 | |
*Витяг зі звіту дослідження PV 16000.
Разова добова доза препарату Вальцит® в обох вищезазначених дослідженнях визначалася за площею поверхні тіла (ППТ) і кліренсом креатиніну (КК), вирахуваним за модифікованою формулою Шварца:
Доза для дитини (мг) = 7 × ППТ × КК (див. формулу для ППТ за Мостеллером і формулу для КК за Шварцом), де:
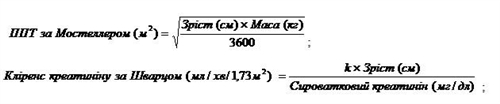
де k = 0,45* для пацієнтів віком <2 років, k = 0,55 для хлопчиків у віці від 2 до 13 років і дівчаток віком від 2 до 16 років, k = 0,7 для хлопчиків у віці від 13 до 16 років.
Доза не повинна перевищувати 900 мг дози для дорослих. Якщо розрахунковий кліренс креатиніну за Шварцом перевищує 150 мл/хв/1,73 м2, то в рівнянні слід використовувати максимальне значення 150 мл/хв/1,73 м2.
Фармакокінетику ганцикловіру після введення валганцикловіру (порошку для орального застосування) також оцінили у двох дослідженнях у новонароджених і немовлят з симптоматичною вродженою ЦМВ-інфекцією. У першому дослідженні 24 новонароджених у віці від 8 до 34 днів отримували ганцикловір 6 мг/кг внутрішньовенно два рази на день. Пацієнти потім отримували валганцикловір перорально, доза валганцикловіру, порошку для орального розчину, становила від 14 мг/кг до 20 мг/кг двічі на день, загальна тривалість лікування становила 6 тижнів. Доза валганцикловіру, порошку для орального розчину, 16 мг/кг двічі на день забезпечує експозицію ганцикловіру, порівнянну з такою при застосуванні 6 мг/кг внутрішньовенно двічі на день у новонароджених, а також аналогічну ефективній внутрішньовенній дозі для дорослих 5 мг/кг.
У другому дослідженні 109 новонароджених у віці від 2 до 30 днів отримували по 16 мг/кг валганцикловіру, порошку для орального розчину, два рази на добу протягом 6 тижнів, а потім 96 зі 109 зареєстрованих пацієнтів були рандомізовані для продовження прийому валганцикловіру або плацебо протягом 6 місяців. Проте середня AUC0-12год була нижче, ніж середні значення AUC0-12год у першому дослідженні. У таблиці 4 наведено середні значення AUC, Cmax і t½, включаючи стандартні відхилення у порівнянні з дорослими.
Таблиця 4. Фармакокінетичні параметри ганцикловіру і валганцикловіру у дітей у порівнянні з дорослими
Фармакокінетичний параметр | Дорослі | Новонароджені і немовлята | ||
| 5 мг/кг ГАН Разова доза (n = 8) | 6 мг/кг ГАН Два рази на день (n=19) | 16 мг/кг ВАЛ Два рази на день (n=19) | 16 мг/кг ВАЛ Два рази на день (n = 100) |
AUC0-∞ (мкг · год/л) | 25,4 ± 4,32 |
Характеристики
Лекарственная форма
Таблетки
Международное непатентованное название
Валганцикловир
Показания
Індукція і підтримувальне лікування цитомегаловірусного ретиніту у пацієнтів з синдромом набутого імунодефіциту (СНІД).
Профілактика ЦМВ-інфекції у ЦМВ-негативних пацієнтів, яким проведено трансплантацію паренхіматозних органів від ЦМВ-позитивних донорів.
Производитель
Accord Healthcare
Срок годности
3 роки
Страна производитель
Польша
Страна регистрации
Польша
Фармакотерапевтическая группа
Противірусні засоби для системного застосування, противірусні засоби прямої дії, нуклеозиди та нуклеотиди, за винятком інгібіторів зворотної транскриптази. Валганцикловір.
Код ATХ J05A B14.
Отзывы
Нет отзывов о данном товаре, станьте первым, оставьте свой отзыв. 
Вопросы и ответы
Нет вопросов о данном товаре, станьте первым и задайте свой вопрос. 
Доставка и оплата
Мы предоставляем надежные и удобные услуги доставки препаратов с использованием службы "Новая почта". Этот выбор обеспечивает быструю и безопасную передачу ваших заказов прямо к вашему порогу или до ближайшего отделения. Способы доставки:
Оплата товара при получении. Мы предоставляем удобную услугу оплаты "Наложенным платежем Новой почты". Это позволяет вам оплатить заказ прямо при получении товара в отделении или курьеру, обеспечивая дополнительный уровень комфорта и уверенности в том что вы получили именно то что заказывали. Срок доставки: Мы стремимся обеспечить максимально быструю доставку вашего заказа. Обычно срок доставки составляет до 5 дней с момента оформления покупки. Мы ценим ваше время и делаем все возможное для того, чтобы вы могли получить ваш заказ как можно скорее. Выберите нас для удобной, надежной и оперативной доставки необходимых Вам препаратов. Реализация Ваших запросов - наш приоритет!
Все лекарства на нашем сайте изготовлены и сертифицированы на территории Евросоюза
Все ваши личные данные не будут переданы 3-м лицам и использоваться в дальнейшем
Есть возможность доставлять препараты из стран Евросоюза, поэтому они дешевле, чем в аптеках Украины
Валганцикловир 450 мг №60
7 500 грн.
| ||